谁是抗PD-1免疫治疗的有效目标人群?(下篇)
再聊聊还有哪些方法可以预测抗PD-1疗效
上篇文章大阅哥帮各位看官理清了已上市的抗PD-1/PD-L1药物,总结了相关联合治疗的效果,并且介绍通过MSI(微卫星不稳定)和TMB(肿瘤突变负荷)伴随检测来预测抗PD-1/PD-L1对患者的疗效。本篇我们将会提到疗效预测研究中运用的其他分析方法,包含PD-L1表达量、免疫细胞表面抗原检测,以及肠道微生物检测。

强大的10× Genomics单细胞测序技术也来了,各位一定坚持看到最后哦!
免疫细胞表面抗原检测
近期发表在Nature medicine (IF:29.886)上的文章<High-dimensional single-cell analysis predicts response to anti-PD-1 immunotherapy>,瑞士苏黎世大学和苏黎世大学医院(UZH)的研究人员发现病人外周血中具有CD14+CD16−HLA-DRhi表型的经典单核细胞(classical monocytes) 比例可以作为衡量病人是否适宜接受抗PD-1/PD-L1免疫治疗的指标。

研究亮点
2、筛选到有效患者(R)和治疗无效患者(NR)血液中含量显著差异的表达CD14+、CD16−、HLA-DRhi的髓细胞亚型。
3、利用计算机建模的方法,基于显著差异表达CD14+、CD16−、HLA-DRhi的髓细胞,对治疗前的患者进行分析和预测,得到较好的结果,能够区分出NR和R,符合实验预期。
实验方法
利用多维的质谱流式技术对黑色素瘤病人治疗前、手术12周后和年龄性别匹配的健康人群样本(n=20,共60个样本)中的外周血单核细胞(PBMC)进行检测。样本分三组为:健康人样本(HD),治疗后有效果者(R),治疗后无效果者(NR)。使用三个独立但部分重叠的大型细胞分析panel对(1)不同细胞表型的淋巴细胞(2)T细胞功能(3)髓细胞亚群进行深度分类分析。第一个panel中含有30种淋巴细胞表面抗原抗体,可鉴定T细胞分化和激活所有阶段的细胞标志物;第二个panel检测T细胞表达细胞生长因子,如 IL-2, IL-4, TNF-α, PD-1 or CTLA-4等的情况,单独的研究T细胞的功能和表型;第三个panel则主要针对髓系细胞进行更深入的亚群分析。
结果分析
在第一个panel分析后,按照表面标记表达强度与趋势,可把N和NR大致分为两组(图1a,绿色代表R与粉色代表NR),并鉴定出了N和NR表达差异大的表面抗原分子(图1b)。同时,基于FlowSOM算法和人工注释,根据表面抗原的表达情况与程度,分类N和NR的细胞群体,图中不同的颜色代表了7类不同的细胞种类(图1c)。紧接着分析了在HD,NR和R中不同种类的细胞聚类频率,由图中得知髓细胞在R病人中显著上调表达(图1d)。
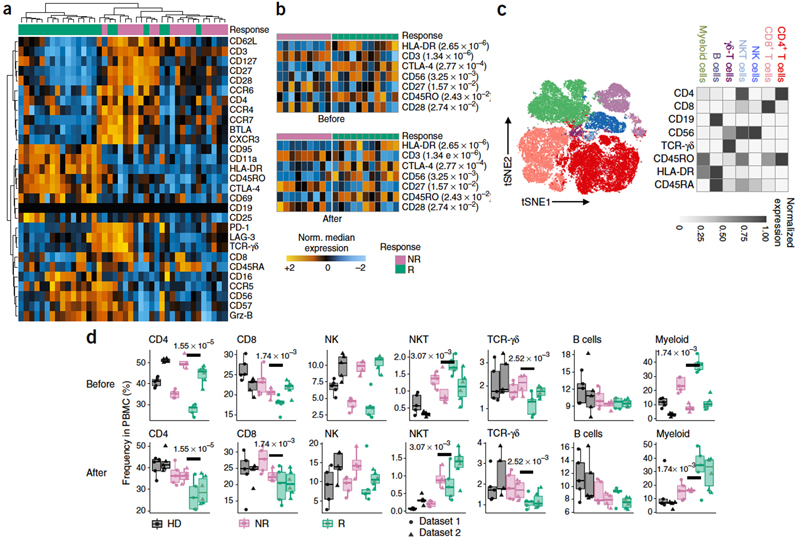
由于T细胞是抗PD-1免疫治疗的主要受体,作者对T细胞的变化情况继续研究比较。针对CD4+和CD8+T细胞上呈现的显著差异表达抗体进行聚类分析。(图2a,b)分别为N和NR的CD4+T细胞和CD8+T细胞上表面抗原的呈现情况,根据分离的CD4+T 细胞和CD8+T细胞上表面抗原表达的不同,把CD4+和CD8+T分成不同T细胞亚系 (TE,EM,CM,Treg) 及研究各亚系在HD, NR, R中的表达频率。结果显示(CM)CD8+T细胞亚系在治疗前与治疗后有良好反应的病人中显著差异。

在图1中,已经得知髓细胞含量在治疗前有良好反应的人群中很高,因此文章对髓细胞的变化趋势进行深入探究。利用FlowSOM分离出的七种类型细胞明显可以看出,在R中的髓细胞含量很高(图3a)。接着,从血液中特异性的分离出髓细胞,对髓上抗原的表达进行聚类分析,按照CD表达的差异性的聚类分析可以基本区分出NR和R(图3b)。(粉色代表NR,绿色代表R,其中左边的聚类中NR的比例为12/14,占86%, 右边聚类分析,R的比例为19/25; 占76%)

最后,用panel3 结合FlowSOM 分析把髓细胞的四个亚型classical monocytes(CD14+、CD16−、HLA-DRhi),CD14−myeloid cells, pDCs 和 cDCs分离出来(图4a),分析四个髓细胞亚型的组成,得出classical monocytes (表面抗原表达情况为CD14+、CD16−、HLA-DRhi)亚型在R和NR病人间差异表达最为显著。为了探究(CD14+、CD16−、HLA-DRhi)亚型细胞的基因表达,对其进行了RNA测序,基因表达情况以聚类热图形式体现,结果显示在R和NR中的基因表达情况并没有明显规律。
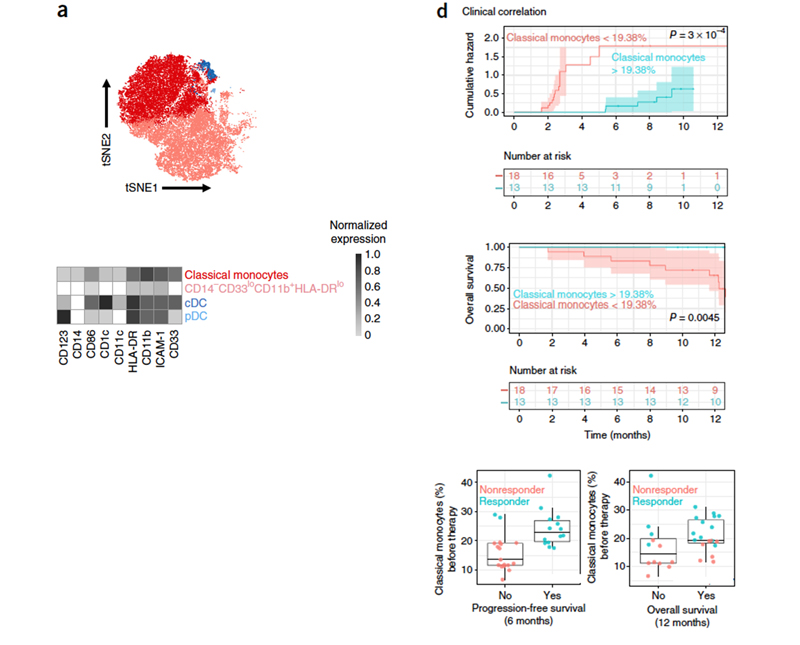
随后,研究人员与UZH瑞士生物信息学研究所学者一起整合分析这些数据,并以免疫细胞CD14+、CD16−、HLA-DRhi变化的分子模式来预测治疗是否成功,结果显示在(图4d)中,证实了表达表面抗原CD14+、CD16−、HLA-DRhi的免疫细胞比例确实具备作为区分抗PD-1治疗后反应的生物标记的潜力。
作者讨论
“在做出免疫治疗的决定前,对患者进行生物标志物的分析可以有效提高免疫治疗对患者的有效率。”来自UZH实验免疫学研究所的Burkhard Becher教授说道,与此同时,提前预测可以让我们在免疫治疗方法不起作用的情况下,及时采取不同的方法,而不会失去宝贵的治疗时间。
能够预测抗PD1/PD-L1疗效的其他方法
PD-L1表达量
在2016年的NCCN指南中曾明确提出对于无明确驱动基因突变的初诊晚期NSCLC肺癌患者可以进行PD-L1表达量的检测,如果PD-L1表达量≥50%,初始治疗可以选择PD-1单抗Keytruda用药。PD-L1表达量的检测是基于细胞蛋白水平的检测,临床试验中以免疫组化方法为主。通常来说,PD-L1表达越高,免疫治疗的有效率就越高。然而,事实却复杂得多,很多PD-L1表达量较高的患者临床治疗无反应,反而许多PD-L1较低的患者响应较好。另一方面,PD-L1表达量检测被广为诟病的就是缺乏统一的标准,每种检测所用到的抗体和具体技术都不同,导致PD-L1阳性的定义只对应于制药企业自己的标准。因此,更多实验数据的支撑和PD-L1表达量检测的统一是这个指标是否可以充当预测免疫疗法疗效的关键点。
Chen, et al. (2016)首次首次提出对肿瘤患者治疗早期TILs检测可以对免疫检查点抑制剂的疗效进行预测。通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。但这种预测方法的相关研究较少,是否能够普及应用还需更多的数据支撑。
2017年11月2日,Science杂志在这一天内同时刊登出了两篇关于肠道微生物与抗PD-1对上皮性肿瘤和黑色素瘤治疗疗效之间关系的文章。Routy B, et al (2018) 等的文章等指出:受抗生素治疗的患者对免疫治疗药物会产生原发耐药性,很快就出现癌症复发,而且具有更短的存活期,这种原发性耐药是由于抗生素使用导致的异常肠道微生物组成引发的。同时,研究发现一种Akkermansia muciniphila有益细菌的相对丰度与癌症患者对免疫疗法的临床反应显著关联。Gopalakrishnan V,et al (2018) 等的文章指出:对抗PD-1免疫治疗作出反应的患者(肠道中具有较高的有益的梭菌/瘤胃球菌水平)有更多的T细胞进入到肿瘤中和更高水平的循环T细胞。两组实验都利用了小鼠粪便移植实验,证明了他们的猜想:肠道微生物调节着癌症免疫疗法的效果。因此,肠道微生物的组成结构在将来很可能成为预测抗PD-1/PD-L1疗效的指标。
单细胞测序
虽然PD-1、PD-L1和CTLA-4是当前火热的肿瘤免疫治疗靶点,但是免疫治疗的靶点绝不仅限于此,筛选出其他重要的治疗靶点也是当前重要的研究任务。由于参与肿瘤发生发展的免疫细胞类型多样、异质性强,在群体细胞水平进行研究很难获得精准的靶点及生物标志物,而单细胞水平的研究对详尽的肿瘤免疫图谱绘制和新型治疗靶点发现具有重要的意义。日前一篇发表在Cell上的文章就利用单细胞测序和传统免疫染色分离结合的方法,通过分析细胞的转录组特征及其对应的T细胞受体信息,指导发现了和PD-1靶点类似的新的有效的T细胞免疫治疗新靶点:LAYN,意义重大 (Zheng et al,2017)。下面就让大阅哥来介绍一下10x Genomics单细胞测序技术吧。
10× Genomics单细胞测序
10x Genomics 单细胞测序自2015年推出至今已有两年多的时间,
在单细胞基因组和转录组水平的研究及应用以迅雷不及掩耳的速度发展。
(1) 单细胞RNA测序(single-cell RNA-seq,简称scRNA-seq)
和传统的血液或组织转录组测序技术不同,单细胞转录组分析以单个细胞为特定研究对象,提取 mRNA 进行逆转录、放大和高通量测序分析,能避开细胞群体的整体基因表达水平,精确揭示单个细胞内基因表达状态和基因结构信息,并反映细胞间的异质性,深入理解其基因型和表型之间的相互关系,在发育生物学、基础医学、临床诊断和药物开发等领域都具有重要作用。
在第一篇文章中,作者运用免疫染色法实现免疫细胞的分离,提取和鉴定,成功找出了能够预测抗PD-1疗效好坏的表达特定表面抗原的免疫细胞。而目前有更多研究利用单细胞测序和传统免疫染色分离结合的方法,融合细胞表面标志物和转录组中基因表达的特点,可以得出具有特殊意义的细胞种类与基因表达特征。除此之外,一些研究基于各类细胞转录组基因表达的特点,可以利用单细胞测序直接鉴定细胞种类,实现细胞种类的区分和鉴定新型细胞亚型的研究目的。(Andrews, Tallulah & Martin,2017;Liu, Serena & Cole Trapnell,2017)
免疫方向:用于外周血单个核细胞细胞亚型的分析,发现细胞亚型新的marker基因。
肿瘤方向:用于发现肿瘤细胞异质性分析和细胞类型鉴定,寻找新的致病途径和机制。
疾病分型:用于发现发生异常增殖的细胞类型,结合传统病理学特征,辅助疾病分型。
干细胞方向:对干细胞不同亚型的特征进行研究,构建干细胞谱系,预测分化方向。
骨髓干细胞移植:监控骨髓干细胞移植病人移植前后的细胞嵌合状态,判断病人术后恢复和移植效果。
鉴定罕见的细胞类型:灵敏检测出数量很少的新细胞类型,增添研究亮点。
T细胞抗原受体(TCR)区域进行测序:不仅可以提供VDJ区域的全长序列,还可以通过序列区分不同T细胞的数量。
微生物方向:实现全长转录本的拼接或微生物全基因组的de novo大片段拼接。

阅微基因可以提供10× Genomics单细胞测序技术,欢迎有需求的客户前来咨询。
参考文献:
1. Zheng, Chunhong, et al. "Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing." Cell (2017)2. Krieg, Carsten, et al. "High-dimensional single-cell analysis predicts response to anti-PD-1 immunotherapy." Nature medicine (2018).
3. Andrews, Tallulah S., and Martin Hemberg. "Identifying cell populations with scRNASeq." Molecular aspects of medicine (2017).
4. Liu, Serena, and Cole Trapnell. "Single-cell transcriptome sequencing: recent advances and remaining challenges." F1000Research (2016).
5. Routy B, et al. "Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors. " Science (2018).
6. Gopalakrishnan, V., et al. "Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients." Science (2018).
7. Chen, et al. "Analysis of immune signatures in longitudinal tumor samples yields insight into biomarkers of response and mechanisms of resistance to immune checkpoint blockade." Cancer discovery (2016).






