{一文读懂}你不知道的BRAF突变与结直肠癌
BRAF突变型结直肠癌(CRC)患者预后较差,现有治疗手段在这一突变患者群体中的疗效不尽理想对于BRAF突变CRC,适当的检查和治疗在临床上是一项较大的挑战,包括发病机制,转移通路和新治疗靶点,都需要更多研究。在过去几十年,肿瘤靶向治疗领域发生了翻天覆地的变化,但是,BRAF这一靶点的突破都在其他瘤种中,比如黑色素瘤,结直肠癌鲜有进展。
本文简要回顾一下BRAF突变型CRC
BRAF突变在所有肿瘤中的突变率在7%左右,但是不同癌症之间差别很大黑色素瘤BRAF突变率接近50%,而结直肠癌为10-25%。
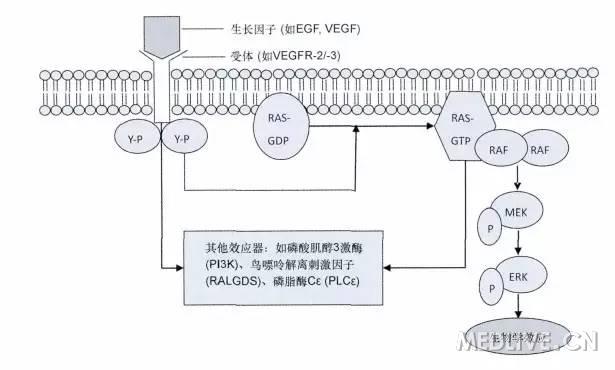
MAPK信号通路
2002年,Nature杂志发表了题为Mutations of the BRAF gene in human cancer的文章,首次阐述了癌基因BRAF突变研究者在癌症基因组计划中发现66%的黑色素瘤细胞系内存在BRAF激酶结构域异常自那时起,已经发现了超过100种BRAF基因突变最常见的是V600E突变:BRAF基因外显子15的第1799位核苷酸T突变为A,导致其编码的缬氨酸被谷氨酸取代。
BRAF是RAF三个亚型之一,是MAPK通路重要的转导因子BRAF-V600E突变体模拟了野生BRAF S598/T601的磷酸化,持续和最大限度的异常增强了激酶活性。
促分裂素原活化蛋白激酶(MAPK)信号转导通路是细胞内最重要的信号通路之一,MAPK/ERK途径主要由RASRAFMEKERK等蛋白激酶组成,通过依次催化下级蛋白激酶发生磷酸化而激活整个信号通路,活化的ERK可以通过影响细胞周期MITF等因子促使细胞生长过度,导致正常细胞向肿瘤细胞转化。
MAPK/ERK通路简要图如下所示:
BRAF突变的检测和筛查
BRAF突变种类众多,但临床上针对CRC的主要检测目标还是V600E突变随着二代测序(NGS)技术的不断应用,检测非V600E突变也越来越容易比如,梅奥诊所的一例转移性CRC患者,NGS检测发现BRAF存在20%的非V600E突变但是,这些非V600E突变在实验研究中作用不尽相同:激活激酶活性,无活性,抑制激酶活性均存在。
截至目前,仅有一项研究报道了非V600E突变患者的临床结局,该研究在10例CRC患者中检测到594个外显子的596个突变与V600突变患者相比,非V600E突变患者的分子特征病理参数临床结局均有较大差异。
临床特点与预后
与无突变的结直肠癌相比,BRAF突变型CRC患者的年龄偏大,女性居多,微卫星不稳定可能性大组织级别高,淋巴结转移率和局部晚期发生率高该型患者的原发灶多位于近端结肠(右半),容易较早出现腹膜和远处淋巴结转移。
在预后方面,无论是早期还是晚期转移CRC,BRAF突变状态都是较强的生存预测因素术后辅助治疗后,BRAF突变型CRC的无病生存期更短,复发后的总生存期更差PETACC-3研究检测了1404例-期结肠癌患者的BRAF和KRAS突变,结果显示,BRAF突变型患者的总生存劣于野生型患者当根据微卫星不稳定分层后,这种差异更加明显。
对于肝脏寡转移,在转移灶根治性切除后,与野生型患者相比,BRAF突变型的无复发生存时间<6个月,且总生存较差若肝转移无法切除则预后更差从整体来看,标准细胞毒化疗后,BRAF突变CRC患者的中位生存期只有野生型患者的1/2-1/3。
BRAF突变状态也可作为EGFR抑制剂治疗的预测指标,突变型患者治疗反应较差
2014年NEJM的一项研究显示,较强的化疗方案FOLFOXIRI联合贝伐珠单抗可能是BRAF突变型CRC的治疗选择之一与FOLFIRI方案相比,FOLFOXIRI+贝伐珠单抗使转移性CRC患者的PFS延长了2.5个月但是,即使是很强的化疗,BRAF突变型CRC患者的生存期依然远远落后于野生型患者,中位OS分别为19.0个月vs 41.7个月靶向治疗。
由于细胞毒药物的获益有限,加之黑色素瘤中针对BRAF突变的靶向治疗前景良好,越来越多的临床试验将BRAF作为一个重要的目标驱动基因。
其中最尴尬的是选择性BRAF-V600E抑制剂vemurafenib单药治疗21例CRC,结果很不理想:1例患者达到部分缓解,总缓解率只有可怜的5%,而该药在黑色素瘤中总缓解率可有60-75%。
失败不可怕,单药vemurafenib的经验告诉我们:
1.BRAF-V600E单一突变难以成就靶向治疗;
2.同一种突变,在结直肠癌和黑色素瘤中有完全不同的疗效反应,说明其内在机制的复杂。
事实上,在CRC和黑色素瘤细胞系内加入BRAF抑制剂,两者的下游信号ERK磷酸化(pERK)的水平明显不同,CRC细胞系pERK非常高,提示上游MAPK通路抑制不足。
另一种靶向治疗策略是BRAF抑制剂(dabrafenib)联合MEK抑制剂(trametinib)在纳入43名转移性BRAF突变型CRC患者的研究中,4例(9%)达到部分缓解,1例(2%)达到持续的完全缓解当然,这样的成绩远不能让人觉得欣慰,但从中我们可以吸取经验:
1.唯一出现完全缓解的患者并没有接受系统治疗,这可能是巧合,但也不能完全排除细胞毒药物对BRAF抑制剂的作用环境产生了影响;
2.从9例患者治疗后15天的活检组织分析来看,pERK水平是有所下降,但下降程度远不及黑色素瘤(37% vs 84%)。
该研究虽然提供了联合靶向的临床有效性数据,但也说明阻断CRC的MAPK通路着实是道难题。
2012年,Nature杂志发文揭示了CRC对BRAF抑制剂抵抗的可能机制,当CRC细胞暴露于BRAF抑制剂时,EGFR异常激活增加,从而绕过MAPK,导致PI3K和AKT通路信号加强当EGFR抑制剂与BRAF抑制剂合用时,MEKERFAKT相关通路信号转导都受到抑制这些研究结果催生了众多联合用药试验,如下图:
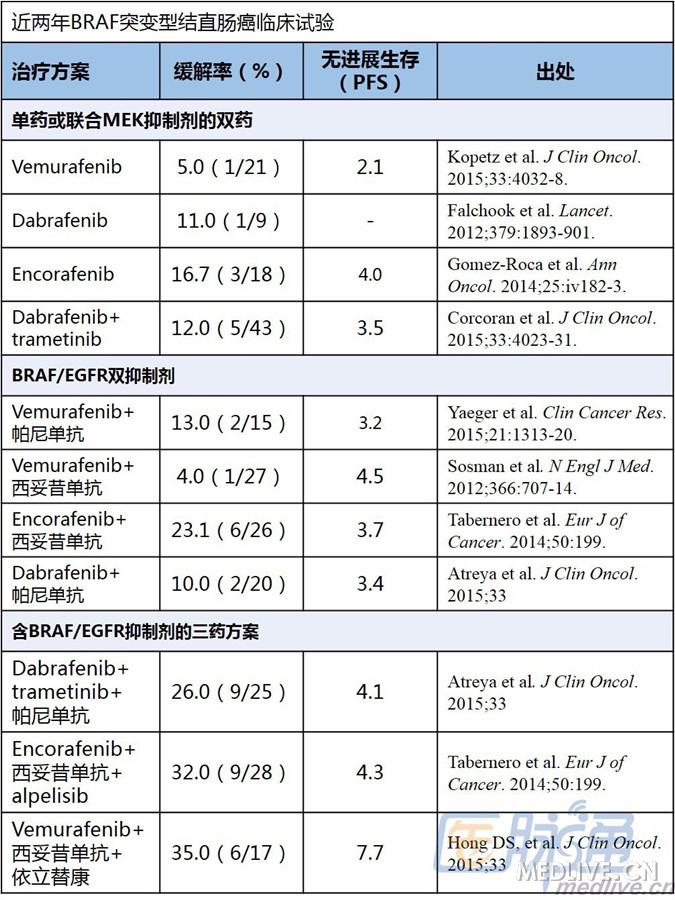
如上图所示,EGFR抑制剂联合BRAF抑制剂的研究还在摸索中,尽管缓解率和PFS都不理想,但鉴于双抑制剂提供的持续性渐进式改善,未来或可成为一种治疗策略。
在EGFR/BRAF双抑制剂的基础上增加第三种药物值得关注
第一种联合是dabrafenib(BRAF抑制剂)+帕尼单抗(EGFR抑制剂)+ trametinib(MEK抑制剂);从最后一次数据更新来看,35名患者中9例(26%)至少达到部分缓解
第二种联合是encorafenib(BRAF抑制剂)+西妥昔单抗(EGFR抑制剂)+ alpelisib(PI3K抑制剂);2014年的更新数据表明,28名患者中9例(32%)至少达到部分缓解
第三种联合是vemurafenib(BRAF抑制剂)+西妥昔单抗+依立替康;17例转移性CRC患者中6例(35%)至少达到部分缓解
展望
有关结直肠癌BRAF突变的研究众多,到目前为止,还未转化成为确实的临床获益从黑色素瘤中引申出的单药BRAF抑制剂治疗,在结直肠癌中以失败告终,折射出我们对信号转导通路理解的浅薄。
挖掘BRAF突变的价值,不仅仅是告诉我们患者预后如何,更为重要的是将其作为治疗靶点改善预后肿瘤存在星罗棋布的多重耐药机制, 多种手段及联合用药治疗也许能更好地封锁各条必经信号通路单打独斗不行,联合EFGRMEK和PI3K激酶抑制剂多管齐下,或许可以有所突破。
另外,BRAF突变型CRC患者微卫星不稳定发生率高,未来甚至可以考虑联合免疫药物PD-1抑制剂增效。
从发现肿瘤基因突变,到研究突变的临床价值,再到开发靶向药物,每一步都需要运气和努力结直肠癌的靶向治疗步履蹒跚,或许真的需要一点运气。






