《Nature》:BRCA1基因变异分级评分指导乳腺癌、卵巢癌患病风险预测
导读:BRCA1/2基因是抑制肿瘤发生的抑癌基因。当BRCA1/2发生基因突变后,其抑制肿瘤发生的功能受到影响,导致基因功能缺陷,从而诱发一系列的癌症,其中最主要的就是遗传性乳腺癌及卵巢癌。已发现的BRCA1基因变异有数千种,但许多都被列为“意义未明的变异”,给患癌风险评估带来了巨大挑战。近日,美国华盛顿大学的研究人员对数千种BRCA1的基因变异按功能进行了更精确的分类,这些功能评分对乳腺癌和卵巢癌罹患风险的基因检测解读或具有临床意义。

图片来自:https://www.nature.com/nature/
乳腺癌是女性中最常见的肿瘤,在有乳腺癌家族史的的女性中大约有20%左右的患者会出现BRCA1或BRCA2基因的突变[1]。BRCA1失去功能的突变与易患早发型乳腺癌和卵巢癌有关。
BRCA1基因较大,包含24个外显子,其功能主要与基因组的稳定性、DNA双链断裂同源重组修复密切相关。虽然已发现的BRCA1基因变异有数千种,但许多都被列为“意义未明的变异”,给患癌风险评估带来了巨大挑战。要弄清这些意义未明的变异,其中一个方法是检测变异基因的表达是否具有恢复DNA修复的功能(BRCA1主要结合RAD51、p53、MSH2等蛋白参与DNA损伤修复过程)[2],这也是肿瘤抑制过程的一部分。
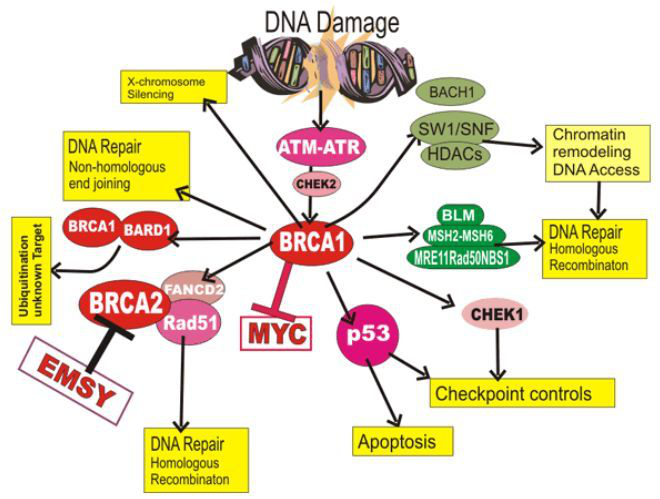
9月13日,美国华盛顿大学的研究人员在《Nature》上发表了题为《Accurate classification of BRCA1 variants with saturation genome editing》[3]的论文,对数千种BRCA1的基因变异按功能进行了更精确的分类。这些功能评分对乳腺癌和卵巢癌罹患风险的基因检测解读或具有临床意义。

在这项研究中,研究人员运用基因组编辑技术,对BRCA1基因功能至关重要的13个外显子上的近4000种单核苷酸变异(SNV)的功能进行了评估(占所有SNV的96.5%),并在2000万个人类单倍体细胞系( human haploid cell line,HAP1)中进行了后续细胞存活率测定。最后,作者识别出了约300种会干扰表达的SNV以及400多种错义突变的SNV(会导致蛋白质的氨基酸序列改变),发现这些变异并无实际功能(不破坏基因的原有功能)。然而,这些功能评分与已知的致病性变异或良性变异的临床评估密切相关。
研究指出,与其它细胞系相比,HAP1细胞系可能不是生理学上的最优模型,但与临床评估的高度相关性验证了数据。作者肯定了功能评分对变异分类的重要价值,并认为研究结果可直接应用于BRCA1基因筛查的解读。
另外,Nature还同期配发了题为《Thousands of short cuts to genetic testing》的评述文章,积极评述了这篇文章,并称这项工作让研究人员意识到精准医学的前景。

中国抗癌协会乳腺癌专业委员会发布的《中国抗癌协会乳腺癌诊治指南与规范》中,明确推荐乳腺癌高危人群进行遗传性BRCA1/2基因检测。阅微基因遗传性乳腺癌/卵巢癌易感基因(BRCA1/2)检测,采用高通量测序联合MLPA方法进行检测,并对结果进行Sanger验证,确保检测结果的准确性,详情请点击:http://www.microread.com/clServ/8-1000-202.html
参考文献:
[1] Kuchenbaecker, K. B., et al. (2017). Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. Jama. DOI:10.1001/jama.2017.7112
[2] Ransburgh, D. J., et al. (2010). Identification of breast tumor mutations in BRCA1 that abolish its function in homologous DNA recombination. Cancer research. DOI:10.1158/0008-5472.CAN-09-2850
[3] Findlay, G. M., et al. (2018). Accurate classification of BRCA1 variants with saturation genome editing. Nature. DOI:10.1038/s41586-018-0416-z
本文来源:搜狐健康







