医生必看:高通量基因测序产前筛查与诊断技术规范
2015年1月15日,卫计委妇幼司发布第一批产前诊断试点单位,同时发布了高通量基因测序产前筛查与诊断技术规范(试行)。与卫计委医政司发布的第一批试点相比,本次妇幼司发布的《通知》更为详细。这份高通量基因测序产前筛查与诊断技术规范(试行)规定了高通量基因测序产前筛查在临床上的适用范围、临床服务流程及临床质量控制。另外,还给出了高通量基因测序产前筛查与诊断知情同意书、临床申请单及临床报告单的参考模板,为试点单位开展高通量基因测序产前筛查与诊断提供了详细的指导。
高通量基因测序产前筛查与诊断技术规范(试行)
为规范高通量基因测序产前筛查与诊断技术临床应用工作,制定本规范。该规范主要包括高通量基因测序产前筛查与诊断的适用范围、临床服务流程和质量控制等内容。
第一部分 适用范围
一、适用目标疾病
根据目前技术发展水平,高通量基因测序技术在产前筛查与诊断领域适用的目标疾病为常见胎儿染色体非整倍体异常(即 21 三体综合征、18 三体综合征、13 三体综合征)。
二、适用时间
高通量基因测序产前筛查与诊断时间应当为12+0-26+6周,最佳检测时间应当为12+0-26+6周。
三、适用人群
(一)血清学筛查、影像学检查显示为常见染色体非整倍体临界风险(即 1/1000≤唐氏综合征风险值<1/270,1/1000≤18 三体综合征风险值<1/350)的孕妇。
(二)有介入性产前诊断禁忌证者(先兆流产、发热、有出血倾向、感染未愈等)。
(三)就诊时,患者为孕 20+6周以上,错过血清学筛查最佳时间,或错过常规产前诊断时机,但要求降低 21 三体综合征、18 三体综合征、13 三体综合征风险的孕妇。
四、慎用人群
有以下几种情形的孕妇属于慎用人群,即在该人群中本检测的筛查效果较适用人群有一定程度下降,即筛查的检出率下降,假阳性及假阴性率上升,或已符合介入性产前诊断的指征,知情后拒绝直接选择介入性产前诊断的孕妇。包括:
(一)产前筛查高风险,预产期年龄≥35 岁的高龄孕妇,以及有其他直接产前诊断指征的孕妇。
(二)孕周<12 周的孕妇。
(三)高体重(体重>100 千克)孕妇。
(四)通过体外受精-胚胎移植(以下简称 IVF-ET)方式受孕的孕妇。
(五)双胎妊娠的孕妇。
(六)合并恶性肿瘤的孕妇。
五、不适用人群
(一)染色体异常胎儿分娩史,夫妇一方有明确染色体异常的孕妇。
(二)孕妇 1 年内接受过异体输血、移植手术、细胞治疗或接受过免疫治疗等对高通量基因测序产前筛查与诊断结果将造成干扰的。
(三)胎儿影像学检查怀疑胎儿有微缺失微重复综合征或其他染色体异常可能的。
(四)各种基因病的高风险人群。
六、其他
(一)对未接受中孕期血清学筛查而直接进行高通量基因测序产前筛查与诊断的孕妇,应当在孕 15 周至 20+6周期间进行胎儿神经管缺陷风险评估。
(二)严禁高通量基因测序产前筛查与诊断用于非医学需要的胎儿性别鉴定。
第二部分 临床服务流程
一、临床技术程序
(一)凡符合适用人群标准并自愿进行此项检测的孕妇,或符合慎用人群标准但强烈要求进行此项检测的孕妇,医师应当对孕妇本人及其家属详细告知该检测的目标病种、目的、意义、准确率、风险和局限性,以及检测的种类、费用和技术流程。
(二)在孕妇充分了解以上事项后,产前诊断机构负责收集孕妇病史、签署知情同意书、采集外周血,根据检测结果,生物信息学分析,确定胎儿是否有相应非整倍体综合征高风险。
(三)医师应当对孕妇提供检测后临床咨询及高风险孕妇的后续处理,在知情同意的前提下对高风险孕妇进行产前诊断,并负责随访妊娠结局。
二、知情同意书签署
(一)产前诊断机构只对已签署知情同意书,同意参加该检测的孕妇进行检测。
(二)医师在孕妇签署知情同意书时应当告知当事人以下要点(知情同意书模板见附图 1):
1. 对存在产前诊断指征的孕妇建议其优先选择介入性产前诊断。
2. 告知该检测能检出的目标疾病种类。
3. 告知该检测能够达到的检出率、假阳性率,强调该检测结果不能视为产前诊断,高风险结果必须行介入性产前诊断确诊;以及低风险结果具有假阴性的可能性。
4. 告知该检测有失败的风险,可能会要求重新采血。
5. 根据知情同意书内容告知该检测的局限性。
6. 根据知情同意书内容告知影响该检测的因素。
7. 医生对病例个案认为应该说明的相关问题。
三、检测申请单填写
(一)医师应当询问孕产史、孕周、胎数和已进行的其他产前检测、产前筛查或产前诊断的结果,以及询问是否进行过细胞治疗、异体输血或是否为肿瘤患者等情况(申请单参考格式见附图 2)。
(二)医师应当协助孕妇准确填写检测申请单上的内容,包括:孕妇姓名、出生日期、采血时体重、孕妇通讯地址和联系电话、末次月经日期、筛查孕周、早孕或中孕期血清学筛查结果等。
四、临床标本的采集
(一)采用唯一编号对采血管进行编号。建议采血管采用条形码作为编号标示,该编号应当与知情同意书和送检单上的编号一致。
(二)按照无菌操作要求,采取孕妇静脉血;样本处理按试剂盒说明书要求进行。
(三)标本的贮存和运输。
1. 已分离的血浆标本运输:在 4-8℃冷藏条件,冷链运输,运输时间不得超过 4 小时;在 0 摄氏度以下的冷冻运输不应超过 72 小时。
2. 已分离的血浆标本长期保存应在-70℃,保存过程中避免反复冻融。
五、检测报告的审核发放
(一)自抽取孕妇外周血至出具检测报告的周期不应当超过 15 个工作日,其中发出因检测失败须再次采样的通知不应当长于 10 个工作日。
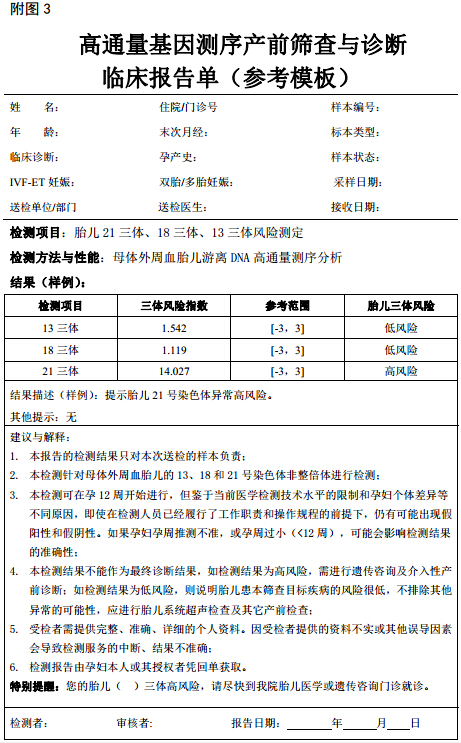
(二)检测报告须经由 1 名具备产前诊断临床资质的副高级以上职称医务人员审核并签发(报告参考格式见附图 3)。
(三)检测报告应当以书面报告形式告知受检者,医务人员应当通知受检者或其家属获取该报告的地点和时间。
(四)报告应当包括以下信息:
1. 孕妇的姓名、年龄、孕周、末次月经时间。
2. 样本编号、样本状态、采样日期和报告日期。
3. 检测项目、检测方法。
4. 每一种目标疾病的检测值,正常参考范围。
5. 以目标疾病的低风险或高风险作为结果报告。
6. 检测者、审核者。
7. 其他相关提示。
(五)对高风险结果的孕妇,试点产前诊断机构应当尽快通过电话或短信息等方式专门通知,建议该孕妇进行后续产前诊断,并做好追踪随访。
六、检测后的临床咨询及高风险孕妇的后续处理
(一)对结果为低风险的孕妇,应当提示此检测并非最终诊断,不排除漏检的可能,且不能排除其他染色体疾病。
(二)对结果为高风险的孕妇,应当建议其进行后续介入性产前诊断;不应当仅根据本检测高风险的结果做终止妊娠的建议和处理。
(三)试点产前诊断机构应当负责高风险病例的后续临床咨询和产前诊断,临床咨询率应达 100%,产前诊断率应达 95%以上。
(四)如果存在胎儿影像学检查异常,无论该检测结果是低风险还是高风险,都应当对其进行专业的遗传咨询及后续相应诊断服务。
七、检测后妊娠结局的追踪随访
(一)试点产前诊断机构应当对所有检测高风险对象进行妊娠结局(包括后期流产、引产、早产或足月分娩等)的追踪随访,随访率应达 100%,失访率宜小于 10%。
(二)试点产前诊断机构对于检测低风险对象妊娠结局的随访率应大于 90%,随访时限应为胎儿出生后 12 周内(建议有条件的试点产前诊断机构随访至产后 1 年)。
(三)随访内容包括:妊娠结局、胎儿或新生儿是否为21 三体综合征、18 三体综合征、13 三体综合征患儿以及其他临床诊断和/或遗传学诊断(建议有条件的产前诊断机构对后期自发流产、死胎、致死性的早产胎儿开展遗传学诊断,作为妊娠结局随访的一部分内容)。
八、资料与标本的保存
高通量基因测序产前筛查与诊断工作相关资料,包括检测送检单、知情同意书以及相关的数据信息均应当在产前诊断机构保存 3 年以上,剩余血浆样本应保存至产后 2 年以上。
第三部分 临床质量控制
一、21 三体综合征检出率应不低于 99%,18 三体综合征检出率应不低于 97%,13 三体综合征检出率应不低于 90%;复合假阳性率应不高于 0.5%;复合阳性预测值应不低于 50%。
二、试点产前诊断机构应当按季度报送临床应用试点工作量及筛查结果,包括筛查检出率、假阳性率、阳性预测值和检出 21 三体综合征、18 三体综合征、13 三体综合征病例数、发生的假阳性和假阴性病例数等数据信息。具体报表见附图 4。
附图:
1. 高通量基因测序产前筛查与诊断知情同意书(参考模板)
2. 高通量基因测序产前筛查与诊断临床申请单(参考模板)
3. 高通量基因测序产前筛查与诊断临床报告单(参考模板)
4. 高通量基因测序产前筛查与诊断临床应用试点 工作情况报表