如何判断PD-1/PD-L1抗体是否有效?
今年6月15日,Nivolumab(商品名Opdivo)获批在中国上市,成为中国第一个获批的PD-1单抗药物,开启了免疫治疗的新纪元;两个月后的8月28日,Opdivo正式开卖,定价可谓全球最低。一大批走投无路的病人看到了曙光,市场对Opdivo的热情高涨。
然而,尽管是“全球最低”,每月的治疗费用仍然高达3~4万元,对于绝大多数家庭,这是一笔巨大的负担;况且,并非所有病人都可以从中受益。因此,如何鉴别可能从药物中获益的病人,成了整个医疗行业都在关心的问题。
科学家发现了众多与药物疗效相关的标记物,如PD-L1表达量、错配修复(MMR)蛋白表达、微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)等等。
进一步研究表明,很难找到单独的一种标记物来预测药物在全部癌症类型中的疗效,我们需要考虑多种标记物给出综合的评判。
今天大阅哥就来给大家介绍一下目前这几种标记物。
1. PD-L1表达量
正常情况下,人体自身的免疫细胞会不断巡视,通过识别癌细胞表面“异己”的信号来发现并杀伤癌细胞。▼
然而,肿瘤细胞往往会表达PD-L1蛋白,而这种蛋白会阻碍人体免疫细胞的功能,进而使得癌细胞逃脱免疫细胞的捕杀[1]。▼
Opdivo通过阻断PD-L1和PD-1的作用,来恢复免疫细胞的杀伤能力。▼
因此,PD-L1的表达量就成为了这类免疫治疗药物的一种标志物。通过免疫组化(IHC)这种常用的生化方法,医生可以衡量PD-L1的表达情况。多项研究证明了PD-L1的表达与Opdivo疗效的正相关性,部分结果见表1[2-5]。
表1 三项临床研究提示PD-L1表达量可以指示Nivolumab疗效
但是,在实验中科学家发现存在一些病人,他们的PD-L1表达量不能指示Nivolumab治疗的获益。这说明,PD-L1表达量作为一种单一因素并不足以预测这类药物的治疗情况,这也开启了后续十余年科学家对于新标志物的不断探寻。
2. MMR蛋白、MSI和TMB
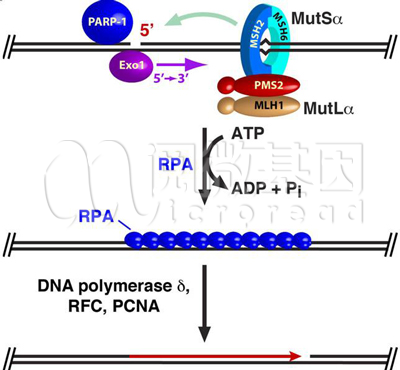
这三个标志物都与免疫检查点抑制剂的疗效相关,尤其是在结直肠癌中,MMR和MSI检测已经成为了NCCN结直肠癌临床指南中公认的检测方法。MMR蛋白检测是通过免疫组化的方法检测MLH-1、MSH-2、MSH-6、PMS2四种蛋白的表达情况。
图1 人类MMR途径示意图
上述四种MMR蛋白是人体的碱基错配修复系统途径中的关键蛋白,一旦由于某种原因造成功能或表达缺失,MMR途径即被破坏,进而导致基因组中错误的大量积累。
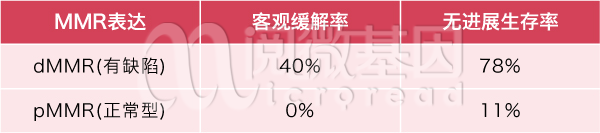
MSI-H和TMB-H都是这样错误积累的后果。也就是说,dMMR(MMR蛋白中至少有一种不表达)会导致MSI-H或TMB-H。这样的基因组错误会带来双重效果:一方面,这样的错误积累很可能诱发癌症,是癌症的风险因素;但另一方面,过多的错误产生了大量的错误蛋白质,使得癌细胞更加“不像”人体的正常细胞,更容易被免疫细胞发现,与免疫药物的良好疗效正相关。传统上,医院倾向于使用免疫组化的方法检测MMR蛋白表达;而近年来,随着测序技术的发展,MSI和TMB检测则成为了迅速发展的两个方向。以MMR检测为例,一项研究的结果如下[6]:
表 2 MMR蛋白与免疫检查点阻断剂疗效的研究
然而,这样的检测方式也有着不足之处:尽管MMR——MSI——TMB这三个概念高度相关,但在实际检测中这三者的结果会有小部分矛盾之处。
举个例子,可能有10%的病人,其MMR结果为pMMR,提示不应使用Opdivo;但MSI结果为MSI-H,提示可以使用Opdivo。这样的矛盾给临床治疗带来了困难;在不同癌症中,这些因素的指示能力不同。
在结直肠癌中,这三者是很好的指示物;但一份近期的研究表明,至少TMB在黑色素瘤中表现不佳。他们发现,黑色素瘤患者的TMB值与黑色素瘤的发病来源高度相关。比如对于那些由于紫外线照射引发癌症的患者,他们的TMB值都很低,但免疫药物的疗效有好有坏[7]。
图2 恶性黑色素瘤中TMB不能解释疗效的差异[7]
3. 肿瘤微环境:浸润T细胞
人体中的肿瘤和实验室中的肿瘤细胞是完全不同的,人体中肿瘤和周围的组织会形成一个相对独立的“社区”,被称为肿瘤微环境。通过各种改造,这样的社区对于肿瘤来讲是十分“舒适”的,它既支持着肿瘤的生长,也帮助肿瘤抵御外部的免疫组织、各种药物的攻击。
在一些情况下,人体自身的免疫T细胞会进入肿瘤社区中,被称为热肿瘤,如下图所示。尽管这些T细胞往往被抑制,无法正常工作,但我们的免疫药物则可以重新激活这些T细胞的活性。因此,Opdivo等药物对于热肿瘤的治疗效果一般较好;而与之相反,在一些“严密”的肿瘤社区中,T细胞很难驻扎进来。
此时,即便使用Opdivo类药物,激活的T细胞也无法攻入肿瘤的领地,无法真正杀死肿瘤。基于这样的现象,检测患者肿瘤附近微环境中的T细胞含量也就称为了一种可能的标志物。如图3所示,可以看到不同种的细胞和肿瘤共同构成了肿瘤微环境,只有激活了图中标出的T细胞,免疫检查点阻断剂才能生效。
图3 肿瘤微环境示意图
此外,还有更多因素等待科研人员进一步挖掘。例如POLE突变会导致TMB超高,可能提示Opdivo等药物的有效性;使用免疫药物治疗后,一小部分病人会出现病情的超进展,有研究认为这一不良预后与MDM2突变相关[8-9],但数据较少,成果并没有得到公认;肿瘤微环境中往往还存在抑制性因素,如TGF-beta因子、调节性T细胞(如上图中黄色的细胞)等,这样的抑制因素可以抑制效应T细胞的正常功能,可能会阻碍药物的正常疗效。
如何准确的找出适合使用抗PD-1/PD-L1抗体的病人,这仍是一个难题。
随着对各项标志物的不断研究,我们可以看到一个趋势:由单一一个标志物来进行预测是不现实的,未来,我们需要综合考虑多个指标,才能获得准确的预测。
此外,由于不同癌症的异质性,找到通用的方案来检测所有肿瘤也是困难重重;我们需要找到一个大框架,并根据不同肿瘤的特点有针对性地进行检测。
为此,我们需要检测结果和临床信息的积累,我们也需要数学、统计学和计算科学的介入。毕竟,在一个精准医学的年代,检测本身也要做到准确而有针对性。
阅微基因PD-L1表达量检测服务,通过免疫组织化学检测(IHC)平台,检测PD-L1蛋白表达水平,以PD-L1阳性肿瘤细胞占比为用药依据;此外,阅微基因研发的肿瘤MSI检测试剂盒,可以准确检测患者的微卫星不稳定情况;TMB检测完善反映细胞突变状态。多项检测强强联手,为有免疫治疗需求的肿瘤患者提供有效的个体化治疗。
参考文献:
[1] Iwai, Y., Ishida, M., Tanaka, Y., Okazaki, T., Honjo, T., & Minato, N. (2002). Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proceedings of the National Academy of Sciences, 99(19), 12293-12297. DOI:10.1073/pnas.192461099
[2] Patel, S. P., et al. (2015). Pd-l1 expression as a predictive biomarker in cancer immunotherapy. Molecular Cancer Therapeutics,14(4), 847-856. DOI:10.1158/1535-7163.MCT-14-0983
[3] Topalian, S. L., et al. (2012). Safety, activity, and immune correlates of anti–PD-1 antibody in cancer. New England Journal of Medicine, 366(26), 2443-2454. DOI:10.1056/NEJMoa1200690
[4] Gettinger, S. N., et al. (2014). First-line nivolumab (anti-PD-1; BMS-936558, ONO-4538) monotherapy in advanced NSCLC: Safety, efficacy, and correlation of outcomes with PD-L1 status.International Journal of Radiation Oncology Biology Physics, 90(5). DOI:10.1016/j.ijrobp.2014.08.204
[5] Grosso, J., et al. (2013). Association of tumor PD-L1 expression and immune biomarkers with clinical activity in patients (pts) with advanced solid tumors treated with nivolumab (anti-PD-1; BMS-936558; ONO-4538).Journal of Clinical Oncology, 31, no. 15_suppl (May 20 2013) 3016-3016. DOI:10.1200/jco.2013.31.15_suppl.3016
[6] Le, D. T., et al. (2015). PD-1 blockade in tumors with mismatch-repair deficiency. New England Journal of Medicine, 372(26), 2509-2520. DOI:10.1056/NEJMoa1500596
[7] Miao, D., et al. (2018). Genomic correlates of response to immune checkpoint blockade in microsatellite-stable solid tumors. Nature genetics, 1. DOI: 10.1038/s41588-018-0200-2
[8] Kato, S., et al. (2017). Hyper-progressors after immunotherapy: analysis of genomic alterations associated with accelerated growth rate. Clinical Cancer Research, clincanres-3133. DOI:10.1158/1078-0432.CCR-16-3133
[9] Champiat, S., Dercle, L., Ammari, S., Massard, C., Hollebecque, A., Postel-Vinay, S., ... & Ferté, C. (2016). Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clinical Cancer Research. DOI:10.1158/1078-0432.CCR-16-1741