一文解忧 | 遇到方法学验证,别慌
【2022-05-12】
在我们为企业客户提供细胞质控或临床前试验的检测检验工作中,常遇到所使用的分子方法未详细载明于药典或标准,需要额外补充方法学验证工作的情况。即使是行业共识视为金标准的方法如Sanger测序、细胞STR鉴定等,我们也都配合客户的申报工作完成方法学验证工作。以下便是我们积累出的一些心得认知,既是分享讨论,也是工作笔记。
方法学验证的必要性
质量分析方法验证就是证明采用的方法适合于相应检测要求,具有相当的准确性和可靠性,进而可以达到控制产品质量的目的。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时,需对分析方法进行验证,只有经过验证的分析方法才能用于控制产品质量。
根据《药品注册检验工作程序和技术要求规范(试行)》要求对受理的药品注册检验申请,需要进行注册标准复核。药品检验机构参照《中国药典》、WHO、ICH等国际机构的有关技术要求和技术指南等,对申请人申报的药品质量标准中检验项目及其标准设置的科学性和合理性、检验方法的适用性和可行性进行评估。
分析方法验证项目
质控分析方法的验证就是根据方法的需要测定该方法的专属性、准确度、精密度、线性、范围、检测限、定量线、耐用性等几个指标中的一个或几个,用于不同检测目的的试验方法需进行不同参数的测定。下表为《中国药典》中9201药品微生物检验替代方法验证指导原则的规定。

方法验证内容
■ 专属性
指在其他成分可能存在时,采用的分析方法能正确测定出被测物的能力。例如分子检测方法学验证的专属性应首先对设计引物的特异性进行分析,若供试品中还存在其它组分,则应进一步验证被检测物中其它组分是否能够引起非特异反应。
■ 检测限
指供试品中的被分析物能够检测到的最低量,但不一定要准确定量,例如对一系列已知浓度分析物的供试品进行分析,并以能测得被分析物的最小量作为检测限。
■ 耐用性
指试验参数被有意进行微小改变时,测量结果不受影响的能力,用于说明使用条件下该分析方法的可靠性。参数的改变可以是仪器、温度等进行调整来验证。
■ 重现性
指相同的样品在正常的实验条件(如实验地点、实验人员、仪器、试剂的批次等)发生变化时,所得检验结果的精密度。
■ 准确性
指测定值与真实值或认可的参考值的一致性或接近程度。一般用回收率(%)表示。生物制品准确性可与同时进行测定的标准品/参考品进行比较而得。
■ 精密度
指在规定条件下对均质供试品多次取样进行一系列检测结果的接近程度,一般表示为变异系数(CV%),变异系数即是测定值的标准差和测定值均数的比值。对于不同测定方法,其精密度可有较大不同,一般情况下,酶法:小于20%;结合试验:小于20%;细胞试验:小于30%;动物试验:小于50%。
■ 定量限
指准确性和精密度都能达到要求时能够定量测定供试品中被分析物的最低量。直观测定法为对一系列已知浓度被分析物的供试品进行分析,在准确性和精密度都符合要求的情况下,来确定被分析物能被定量的最小值。
■ 线性
指在给定的范围内检测结果与供试品中被分析物的成比例关系。可直接对标准品、供试品进行测定,以信号对被分析物的浓度作图,根据图形是否呈线性进行评价。
■ 范围
指能达到一定的准确性、精密度和线性时被分析物的较高和较低浓度(量)的一个区间。具体的范围一般根据检测的目的而设定,通常从线性研究中得到。确定范围的方法为:供试品浓度(含量)在范围末端和范围内时,均能获得满意的线形、精密度和准确性。
案例经验
■ 一个定性方法学验证案例
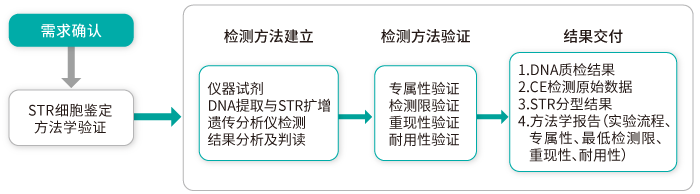
专属性确认存在外来成分也不会干扰试验而影响结果;供试品至少重复进行3次都能检出的最低量作为检测限;相同实验条件变更实验人员,实验地点等结果无误验证表明具有重现性;更换仪器和微小参数结果相同来证明其耐用性。
■ 一个定量方法学验证案例
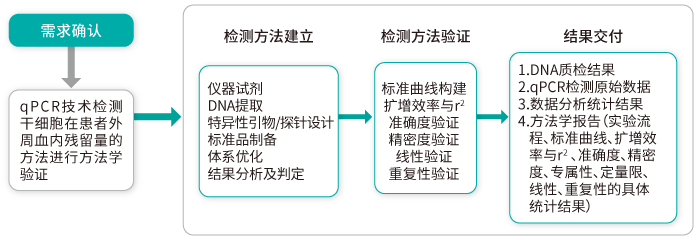
标准曲线,其R2≥98%,扩增效率在90%~110%范围内;准确度在±15%范围内,对于定量下限准确度在±20%范围内;同时重复试验其SD均值、CV均值,合格判定标准为变异系数不超过15%,定量下限的变异系数不超过20%范围。
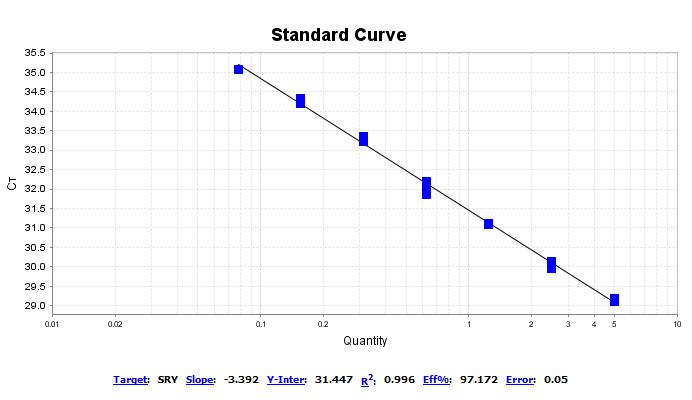
qPCR标准曲线图
其他项目经验:细胞STR鉴定、细胞种属鉴定,端粒酶活性检测、mRNA疫苗体内残留检测等。
结语
方法学验证的基本原则,便是根据方法的来源、测试原理、方法的技术特点以及具体的验证结果等,对于质控分析方法的准确性和可靠性进行综合分析,并评价由拟定的质控分析方法构成的制检规程能否基本控制产品质量。不同方法的验证方案在遵循药典指导原则下,可针对应用增减调整试验项目。我们收到客户要求进行方法学验证需求时,会先出具初步方案、具体讨论、议定选用标准品/参考品、项目完整性及合格要求等,而后具体实施并提交验证报告。

参考资料:
[1] 《中国药典2020年版》:9101分析方法验证指导原则;9201药品微生物检验替代方法验证指导原则.
[2] 生物制品质量控制分析方法验证技术审评一般原则.【S】GPH1-1.
[3] 药品注册检验工作程序和技术要求规范(试行). 2020年版.







